Bromuro de estaño (II)
| Bromuro de estaño (II) | ||
|---|---|---|
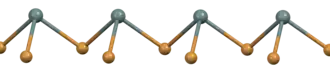 Parte de una cadena (SnBr2)∞ en estado sólido[1] | ||
| General | ||
| Otros nombres | dibromuro de estaño, bromuro de estaño | |
| Fórmula molecular | SnBr2 | |
| Identificadores | ||
| Número CAS | 10031-24-0[2] | |
| ChemSpider | 59609 | |
| PubChem | 21114697 66224, 21114697 | |
| UNII | 55F23H2K96 | |
| Propiedades físicas | ||
| Densidad | 5120 kg/m³; 5,12 g/cm³ | |
| Masa molar | 277,7388689 g/mol | |
| Punto de fusión | 215 °C (488 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El bromuro de estaño (II) es un compuesto químico de estaño y bromo cuya fórmula es SnBr2. El estaño se encuentra en el estado de oxidación +2. La estabilidad de los compuestos de estaño en este estado de oxidación se atribuye al efecto de par inerte.[3]
Estructura y enlace
En fase gaseosa, el SnBr2 es no lineal y presenta una configuración doblada similar a la del SnCl2 en fase gaseosa. El ángulo entre los átomos de bromo y estaño es de 95° y la longitud del enlace entre ellos es de 255 pm.[4] Hay indicios de dimerización en la fase gaseosa.[5] La estructura en estado sólido está relacionada con la de SnCl2 y PbCl2, y los átomos de estaño tienen cinco átomos de bromo próximos en una configuración bipiramidal aproximadamente trigonal.[6] Existen dos polimorfos: un polimorfo ortorrómbico a temperatura ambiente y un polimorfo hexagonal a alta temperatura. Ambos contienen cadenas (SnBr2)∞, pero la disposición del empaquetamiento es diferente.
Preparación
El bromuro de estaño (II) se puede preparar mediante la reacción de estaño metálico y HBr, destilando el H2O/HBr y enfriando:[9]
- Sn + 2 HBr → SnBr2 + H2
Sin embargo, la reacción producirá bromuro de estaño (IV) en presencia de oxígeno.
Reacciones
El SnBr2 es soluble en disolventes donantes como la acetona, la piridina y el dimetilsulfóxido, con los que se obtienen aductos piramidales. Se conocen varios hidratos, 2SnBr2·H2O, 3SnBr2·H2O & 6SnBr2·5H2O, que en la fase sólida tienen estaño coordinado por un prisma trigonal distorsionado de 6 átomos de bromo con Br o H2O tapando 1 o 2 caras.[3] Cuando se disuelve en HBr se forma el ion piramidal SnBr3−. [3] Al igual que el SnCl2, es un agente reductor. Con varios bromuros de alquilo puede ocurrir una adición oxidativa para producir el tribromuro de alquilestaño [10] por ejemplo
- SnBr2 + RBr → RSnBr3
El bromuro de estaño (II) puede actuar como un ácido de Lewis, formando aductos con moléculas donantes, por ejemplo, trimetilamina, con la que forma NMe3·SnBr2 y 2NMe3·SnBr2.[11] También puede actuar como donante y aceptor, por ejemplo, en el complejo F3B·SnBr2·NMe3, donde es donante para el trifluoruro de boro y aceptor para la trimetilamina. [12]
Referencias
- ↑ a b c Eckold, Pierre; Hügel, Werner; Dinnebier, Robert E.; Niewa, Rainer (2005). «Two Modifications of Tin(II) Bromide». Zeitschrift für anorganische und allgemeine Chemie 641 (8–9): 1467-1472. doi:10.1002/zaac.201500108.
- ↑ Número CAS
- ↑ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2 edición). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ J.L Wardell "Tin:Inorganic Chemistry" Encyclopedia of Inorganic Chemistry Ed: R Bruce King John Wiley & Sons (1994) ISBN 0-471-93620-0
- ↑ K. Hilpert; M. Miller; F. Ramondo (1991). «Thermochemistry of tetrabromoditin and bromoiodotin gaseous». J. Phys. Chem. 95 (19): 7261-7266. doi:10.1021/j100172a031.
- ↑ Abrahams I.; Demetriou D.Z. (2000). «Inert Pair Effects in Tin and Lead Dihalides: Crystal Structure of Tin(II) Bromide». Journal of Solid State Chemistry 149 (1): 28-32. Bibcode:2000JSSCh.149...28A. doi:10.1006/jssc.1999.8489.
- ↑ «ICSD Entry: 429132». Cambridge Structural Database: Access Structures (Cambridge Crystallographic Data Centre). Consultado el 9 de febrero de 2022.
- ↑ «ICSD Entry: 429133». Cambridge Structural Database: Access Structures (Cambridge Crystallographic Data Centre). Consultado el 9 de febrero de 2022.
- ↑ Advanced inorganic chemistry (6th ed edición). J. Wiley. 1999. ISBN 978-0-471-19957-1.
- ↑ Bulten E.J. (1975). «A convenient synthesis of (C1-C18) alkyltin tribromides». Journal of Organometallic Chemistry 97 (1): 167-172. doi:10.1016/S0022-328X(00)89463-2.
- ↑ Chung Chun Hsu; R. A. Geanangel (1977). «Synthesis and studies of trimethylamine adducts with tin(II) halides». Inorg. Chem. 16 (1): 2529-2534. doi:10.1021/ic50176a022.
- ↑ Chung Chun Hsu; R. A. Geanangel (1980). «Donor and acceptor behavior of divalent tin compounds». Inorg. Chem. 19 (1): 110-119. doi:10.1021/ic50203a024.
Enlaces externos
- Esta obra contiene una traducción derivada de «Tin(II) bromide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.