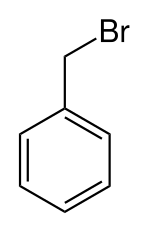
Bromuro de bencilo
| Bromuro de bencilo | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| (bromometil)benceno | ||
| General | ||
| Otros nombres |
α-Bromotolueno Bromuro de bencilo | |
| Fórmula molecular | C7H8Br | |
| Identificadores | ||
| Número CAS | 100-39-0[1] | |
| ChEBI | 59858 | |
| ChEMBL | CHEMBL1085946 | |
| ChemSpider | 13851576 | |
| PubChem | 7498 | |
| UNII | XR75BS721D | |
| Propiedades físicas | ||
| Densidad | 1438 kg/m³; 1,438 g/cm³ | |
| Masa molar | 171,03448 g/mol | |
| Punto de fusión | 269,15 K (−4 °C) | |
| Punto de ebullición | 472,15 K (199 °C) | |
| Compuestos relacionados | ||
| Halogenuros de bencilo |
Fluoruro de bencilo, Cloruro de bencilo, Ioduro de bencilo. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
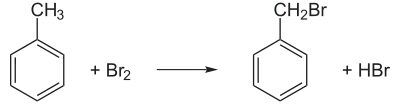
El bromuro de bencilo es un compuesto orgánico de fórmula C
6H
5CH
2Br cuya estructura corresponde a un anillo de benceno sustituido con un grupo bromometilo. Es un líquido incoloro con propiedades lacrimógenas. El compuesto es un reactivo para introducir grupos bencílicos.[2][3]
Síntesis y estructura
El bromuro de bencilo puede sintetizarse mediante bromación del tolueno en condiciones que favorecen la halogenación de radicales libres:
La estructura se ha examinado mediante difracción de electrones.[4]
Aplicaciones
El bromuro de bencilo se utiliza en síntesis orgánica para introducir grupos bencilo cuando el cloruro de bencilo, que es menos caro, no es suficientemente reactivo.[5][6]
Las benzilaciones se consiguen a menudo en presencia de cantidades catalíticas de yoduro de sodio, que genera in situ el yoduro de bencilo, que es más reactivo.[2]
En algunos casos, el bencilo sirve como grupo protector para alcoholes y ácidos carboxílicos.[7]
Seguridad
El bromuro de bencilo es un potente lacrimógeno que también irrita intensamente la piel y las membranas mucosas. Debido a estas propiedades, se ha utilizado en la guerra química, tanto en combate como en entrenamiento, por su naturaleza irritante pero no letal.
Véase también
Referencias
- ↑ Número CAS
- ↑ a b William E. Bauta (2001). «Benzyl Bromide». Encyclopedia of Reagents for Organic Synthesis. ISBN 0-471-93623-5. doi:10.1002/047084289X.rb047.
- ↑ «Benzyl bromide». Sigma Aldrich. sigmaaldrich.com. Consultado el 8 de junio de 2017.
- ↑ Vilkov, L. V.; Sadova, N. I. (March 1976). «Electron diffraction study on the molecular structure of benzyl chloride and benzyl bromide in the vapour phase». Journal of Molecular Structure 31 (1): 131-142. Bibcode:1976JMoSt..31..131S. doi:10.1016/0022-2860(76)80124-X.
- ↑ Andrew G. Myers; Bryant H. Yang (2000). «Synthesis and Diastereoselective Alkylation of Pseudoephenedrine Amides». Org. Synth. 77: 22. doi:10.15227/orgsyn.077.0022.
- ↑ Harry Heaney; Steven V. Ley (1974). «1-Benzylindole». Org. Synth. 54: 58. doi:10.15227/orgsyn.054.0058.
- ↑ «Benzyl bromide». chemicalbook.com. Consultado el 8 de junio de 2017.
Enlaces externos
- Esta obra contiene una traducción derivada de «Benzyl bromide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.