Beta termodinámica
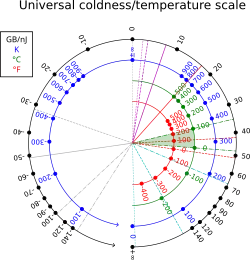
En la termodinámica estadística, la beta termodinámica, también conocida como frialdad,[1] es el recíproco de la temperatura termodinámica de un sistema: (donde T es la temperatura y kB es la constante de Boltzmann).[2]
La beta termodinámica tiene unidades recíprocas a las de la energía (en unidades SI, recíprocos de julios, ). En unidades no térmicas, también puede medirse en byte por julio, o más convenientemente, gigabyte por nanojulio;[3] 1 K−1 equivale a aproximadamente 13,062 gigabytes por nanojulio; a temperatura ambiente: T = 300K, β ≈ 44 GB/nJ ≈ 39 eV−1 ≈ 2.4×1020 J−1. El factor de conversión es 1 GB/nJ = J−1.
Descripción
La beta termodinámica es esencialmente la conexión entre la teoría de la información y la interpretación de la mecánica estadística de un sistema físico a través de su entropía y la termodinámica asociada con su energía. Expresa la respuesta de la entropía ante un aumento de energía. Si se añade una pequeña cantidad de energía al sistema, entonces β describe cuánto se aleatorizará el sistema.
Mediante la definición estadística de la temperatura como función de la entropía, la función de frialdad puede calcularse en el conjunto microcanónico a partir de la fórmula
(es decir, la derivada parcial de la entropía S respecto a la energía E a volumen constante V y número de partículas N).
Ventajas
Aunque es completamente equivalente en contenido conceptual a la temperatura, β se considera generalmente una cantidad más fundamental que la temperatura debido al fenómeno de la temperatura negativa, en el cual β es continua al cruzar cero mientras que T presenta una singularidad.[4]
Además, β tiene la ventaja de ser más fácil de entender causalmente: si se añade una pequeña cantidad de calor a un sistema, β es el aumento de entropía dividido por el aumento de calor. La temperatura es difícil de interpretar en el mismo sentido, ya que no es posible "añadir entropía" a un sistema excepto indirectamente, modificando otras cantidades como la temperatura, el volumen o el número de partículas.
Interpretación estadística
Desde el punto de vista estadístico, β es una cantidad numérica que relaciona dos sistemas macroscópicos en equilibrio. La formulación exacta es la siguiente. Consideremos dos sistemas, 1 y 2, en contacto térmico, con energías respectivas E1 y E2. Suponemos que E1 + E2 = una constante E. El número de microestados de cada sistema se denotará por Ω1 y Ω2. Bajo nuestras suposiciones, Ωi depende solo de Ei. También asumimos que cualquier microestado del sistema 1 consistente con E1 puede coexistir con cualquier microestado del sistema 2 consistente con E2. Por lo tanto, el número de microestados para el sistema combinado es
Derivaremos β a partir de la suposición fundamental de la mecánica estadística:
- Cuando el sistema combinado alcanza el equilibrio, el número Ω se maximiza.
(En otras palabras, el sistema busca naturalmente el número máximo de microestados.) Por lo tanto, en equilibrio,
Pero E1 + E2 = E implica
Así que
es decir,
La relación anterior motiva una definición de β:
Conexión de la visión estadística con la visión termodinámica
Cuando dos sistemas están en equilibrio, tienen la misma temperatura termodinámica T. Por lo tanto, intuitivamente, se esperaría que β (definida a través de microestados) esté relacionada de alguna manera con T. Este vínculo lo proporciona la suposición fundamental de Boltzmann escrita como
donde kB es la constante de Boltzmann, S es la entropía termodinámica clásica y Ω es el número de microestados. Así,
Sustituyendo en la definición de β desde la definición estadística anterior da
Comparando con la fórmula termodinámica
tenemos
donde se llama la temperatura fundamental del sistema y tiene unidades de energía.
Historia
La beta termodinámica fue introducida originalmente en 1971 (como Kältefunktion "función de frialdad") por Ingo Müller, uno de los defensores de la escuela de pensamiento de la termodinámica racional[5][6] basándose en propuestas anteriores para una función de "temperatura recíproca".[1][7]
Véase también
Referencias
- ↑ a b Day, W. A.; Gurtin, Morton E. (1 de enero de 1969). «On the symmetry of the conductivity tensor and other restrictions in the nonlinear theory of heat conduction». Archive for Rational Mechanics and Analysis (en inglés) 33 (1): 26-32. Bibcode:1969ArRMA..33...26D. ISSN 1432-0673. doi:10.1007/BF00248154.
- ↑ Meixner, J. (1 de septiembre de 1975). «Coldness and temperature». Archive for Rational Mechanics and Analysis (en inglés) 57 (3): 281-290. Bibcode:1975ArRMA..57..281M. ISSN 1432-0673. doi:10.1007/BF00280159.
- ↑ Fraundorf, P. (1 de noviembre de 2003). «Heat capacity in bits». American Journal of Physics (en inglés) 71 (11): 1142-1151. Bibcode:2003AmJPh..71.1142F. ISSN 0002-9505. doi:10.1119/1.1593658.
- ↑ Kittel, Charles; Kroemer, Herbert (1980), Thermal Physics (2 edición), United States of America: W. H. Freeman and Company, ISBN 978-0471490302.
- ↑ Müller, Ingo (1971). «Die Kältefunktion, eine universelle Funktion in der Thermodynamik wärmeleitender Flüssigkeiten» [La función de frialdad, una función universal en la termodinámica de líquidos conductores de calor]. Archive for Rational Mechanics and Analysis 40: 1-36. doi:10.1007/BF00281528.
- ↑ Müller, Ingo (1971). «The Coldness, a Universal Function in Thermoelastic Bodies». Archive for Rational Mechanics and Analysis 41 (5): 319-332. Bibcode:1971ArRMA..41..319M. doi:10.1007/BF00281870.
- ↑ Castle, J.; Emmenish, W.; Henkes, R.; Miller, R.; Rayne, J. (1965). Science by Degrees: Temperature from Zero to Zero. Nueva York: Walker and Company.