Autoprotólisis
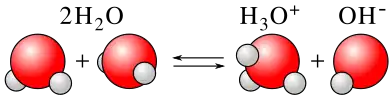
Se denomina autoprotólisis al equilibrio químico que presentan algunas especies químicas, como por ejemplo, las moléculas de agua. En la autoprotólisis una de las moléculas actúa como un ácido de Brønsted, liberando un protón que es aceptado por la otra molécula actuando como un base de Brønsted].[1] En el ejemplo de la autoprotólisis del agua, el intercambio de propones alcanza un equilibrio según la reacción que se muestra a continuación:
formándose un ion hidronio (H3O+) y otro hidroxilo (OH-). Esta reacción también recibe el nombre de autoionización del agua y el equilibrio se encuentra muy desplazado hacia la izquierda, de forma que la concentración de estos iones en agua pura y a una temperatura de 25 °C, es muy baja, del orden de 10-7 mol/L.[2] A pesar de la baja concentración de estas especies, una leve alteración en la concentración de cualquiera de ellas, puede tener implicaciones muy importantes desde el punto de vista de la reactividad de las sustancias presentes en disolución. La sola adición de unas gotas de ácido clorhídrico concentrado a un litro de agua pura puede variar el pH original en varias unidades.
Otros ejemplos
En general, cualquier solvente que contenga protones reactivos (solventes próticos) pueden experimentar autoprotólisis. Así por ejemplo, el ácido acético puro, sin trazas de agua:[3]
o el amoníaco en su forma más pura puede someterse a autoprotolisis:
así como el metanol y otros más.
Véase también
Referencias
- ↑ Unión Internacional de Química Pura y Aplicada. «autoprotolysis». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Morcillo, J. (1980). Temas básicos de Química. Madrid: Alhambra. pp. 261-262. ISBN 84-205-0382-7.
- ↑ Harris, Daniel C. (1992). Análisis Químico Cuantitativo. Grupo Editorial Iberoamericana. pp. 83-84. ISBN 970-625-003-4.