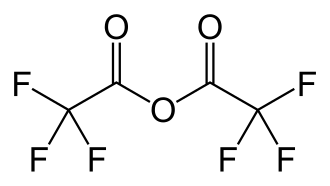
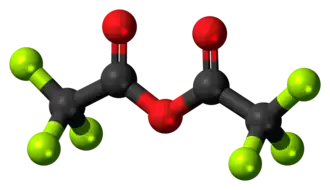
Anhídrido trifluoroacético
| Anhídrido trifluoroacético | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Otros nombres |
2,2,2-Anhídrido trifluoroacético TFAA | |
| Fórmula molecular | C4F6O3 | |
| Identificadores | ||
| Número CAS | 407-25-0[1] | |
| Número RTECS | AJ9800000 | |
| ChemSpider | 21106178 | |
| PubChem | 9845 | |
| UNII | 5ENA87IZHT | |
| Propiedades físicas | ||
| Apariencia | líquido[2] | |
| Densidad | 1511 kg/m³; 1,511 g/cm³ | |
| Masa molar | 209,975 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El anhídrido trifluoroacético ( TFAA ) es el anhídrido ácido del ácido trifluoroacético. Es el derivado perfluorado del anhídrido acético .
Preparación
El anhídrido trifluoroacético se preparó originalmente mediante la deshidratación del ácido trifluoroacético con pentóxido de fósforo . [3] La deshidratación también puede realizarse con cloruros ácidos α-halogenados en exceso Por ejemplo, con cloruro de dicloroacetilo:
- 2 CF3COOH + Cl2CHCOCl → (CF3CO)2O + Cl2CHCOOH + HCl
Usos
El anhídrido trifluoroacético tiene varios usos en la síntesis orgánica.
Puede utilizarse para introducir el correspondiente grupo trifluoroacetilo, para lo cual es más conveniente que el correspondiente cloruro de acilo, ya que el cloruro de trifluoroacetilo es un gas.
Puede utilizarse para promover reacciones de ácidos carboxílicos, incluida la acilación de Friedel-Crafts y la acilación de otros compuestos insaturados. Con el anhídrido trifluoroacético también se pueden promover otras reacciones de sustitución aromática electrofílica, como la nitración, la sulfonación y la nitrosilación. [3]
De manera similar al anhídrido acético, el anhídrido trifluoroacético se puede utilizar como agente deshidratante y como activador del reordenamiento de Pummerer . [4]
Se puede utilizar en lugar del cloruro de oxalilo en la oxidación de Swern, permitiendo temperaturas de hasta -30 °C. [5]
Con yoduro de sodio, reduce los sulfóxidos a sulfuros. [4]
El anhídrido trifluoroacético es el desecante recomendado para el ácido trifluoroacético. [6]
Referencias
- ↑ Número CAS
- ↑ Anhídrido de ácido trifluoroacético SDS Safety Data Sheet for Anhídrido de ácido trifluoroacético 808261
- ↑ a b Tedder, J. M. (1955). «The Use of Trifluoroacetic Anhydride and Related Compounds in Organic Synthesis». Chem. Rev. 55 (5): 787-827. doi:10.1021/cr50005a001.
- ↑ a b Sweeney, Joseph; Perkins, Gemma; DiMauro, Erin F.; Hodous, Brian L. (2005). «Trifluoroacetic Anhydride». Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. ISBN 978-0-470-84289-8. doi:10.1002/047084289X.rt237.pub2.
- ↑ Omura, Kanji; Sharma, Ashok K.; Swern, Daniel (1976). «Dimethyl Sulfoxide-Trifluoroacetic Anhydride. New Reagent for Oxidation of Alcohols to Carbonyls». J. Org. Chem. 41 (6): 957-962. doi:10.1021/jo00868a012.
- ↑ Chai, Christina Li Lin; Armarego, W. L. F. (2003). Purification of laboratory chemicals (Google Books excerpt). Oxford: Butterworth-Heinemann. p. 376. ISBN 0-7506-7571-3.
Enlaces externos
- Esta obra contiene una traducción derivada de «Trifluoroacetic anhydride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.