3-hidroxiacil-CoA deshidrogenasa
| 3-hidroxiacil-CoA deshidrogenasa | ||||
|---|---|---|---|---|
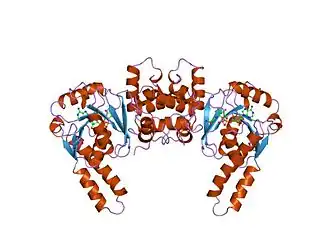 Estructura de una 3-hidroxiacil-CoA deshidrogenasa humana cristalizada.[1] | ||||
| Estructuras disponibles | ||||
| PDB |
Buscar ortólogos: | |||
| Identificadores | ||||
| Símbolo | HADH (HGNC: 4799) | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 1.1.1.35 | |||
| Número CAS | 9028-40-4 | |||
| Ortólogos | ||||
| Especies |
| |||
| UniProt |
| |||
| RefSeq (proteína) NCBI |
| |||
| Ubicación (UCSC) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
En enzimología, una 3-hidroxiacil-CoA deshidrogenasa (EC 1.1.1.35) es una enzima que cataliza la reacción química:
- (S)-3-hidroxiacil-CoA + NAD + 3-oxoacil-CoA + NADH + H +
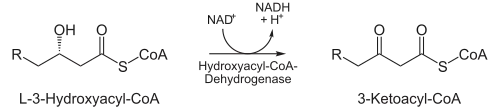
Así, los dos sustratos de esta enzima son (S)-3-hidroxiacil-CoA y NAD+, mientras que sus 3 productos son 3-oxoacil-CoA, NADH y H+.
Esta enzima pertenece a la familia de las oxidorreductasas, concretamente aquellas que actúan sobre el grupo CH-OH del donador con NAD+ o NADP+ como aceptor.
isoenzimas
En los humanos, los siguientes genes codifican proteínas con actividad 3-hidroxiacil-CoA deshidrogenasa:
- HADH – Hidroxiacil-coenzima A deshidrogenasa
- HSD17B10 – 3-Hidroxiacil-CoA deshidrogenasa tipo 2
- EHHADH – Enzima bifuncional peroxisomal
- HSD17B4 – Enzima multifuncional peroxisomal tipo 2
Función
La 3-hidroxiacil CoA deshidrogenasa se clasifica como una oxidorreductasa. Participa en los procesos metabólicos de los ácidos grasos. Específicamente, cataliza el tercer paso de la beta oxidación; la oxidación de L-3-hidroxiacil CoA por NAD+. La reacción convierte el grupo hidroxilo en un grupo ceto.
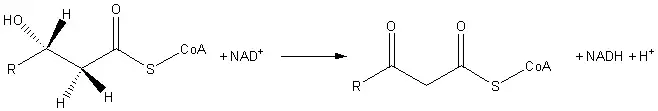
El producto final es el 3-cetoacil CoA.
Vías metabólicas
Esta enzima participa en 8 vías metabólicas :
- Elongación de ácidos grasos en las mitocondrias
- Metabolismo de los ácidos grasos
- Degradación de valina, leucina e isoleucina
- Degradación de lisina
- Metabolismo del triptófano
- Degradación del benzoato mediante ligadura de coa
- Metabolismo del butanoato
- Degradación de la caprolactama
Nomenclatura
El nombre sistemático de esta clase de enzima es (S)-3-hidroxiacil-CoA:NAD+ oxidorreductasa. Otros nombres de uso común incluyen:
- Beta-hidroxibutírico deshidrogenasa ligada a DPN 1-específica
- 3-hidroxiacetil-coenzima A deshidrogenasa
- 3-hidroxiacil-coenzima A deshidrogenasa
- 3-hidroxibutiril-CoA deshidrogenasa
- 3-hidroxiisobutiril-CoA deshidrogenasa
- 3-ceto reductasa
- 3-L-hidroxiacil-CoA deshidrogenasa
- 3beta-hidroxiacil-coenzima A deshidrogenasa
- beta-hidroxiácido deshidrogenasa
- beta-hidroxiacil-CoA deshidrogenasa
- beta-hidroxiacil-deshidrogenasa
- beta-hidroxiacil-coenzima A sintetasa
- beta-hidroxiacilcoenzima A deshidrogenasa
- beta-hidroxibutirilcoenzima A deshidrogenasa
- beta-ceto-reductasa
- beta-cetoacil-CoA reductasa
- L-3-hidroxiacil CoA deshidrogenasa
- L-3-hidroxiacil coenzima A deshidrogenasa
Estudios estructurales
Hasta el 20 de enero de 2010, se han resuelto 22 estructuras para esta clase de enzimas, con los códigos de acceso PDB 1F0Y, 1F12, 1F14, 1F17, 1F67, 1GZ6, 1IKT, 1IL0, 1LSJ, 1LSO, 1M75, 1M76, 1S9C, 1WDK, 1WDL, 1WDM, 1ZBQ, 1ZCJ, 2D3T, 2HDH, 3HAD y 3HDH .
Referencias
- ↑ «Biochemical Characterization and Crystal Structure Determination of Human Heart Short Chain l-3-Hydroxyacyl-CoA Dehydrogenase Provide Insights into Catalytic Mechanism». Biochemistry 38 (18): 5786-5798. 1999. PMID 10231530. doi:10.1021/bi9829027.