Óxido de litio
| Óxido de litio | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Fórmula molecular | Li2O | |
| Identificadores | ||
| Número CAS | 12057-24-8[1] | |
| Número RTECS | OJ6360000 | |
| ChemSpider | 145811 | |
| PubChem | 166630 | |
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Masa molar | 29,88 g/mol | |
| Punto de fusión | 1438 °C (1711 K) | |
| Punto de ebullición | 2600 °C (2873 K) | |
| Riesgos | ||
| Riesgos principales | Corrosivo. Reacciona violentamente con agua. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El óxido de litio (Li2O) es un compuesto químico inorgánico que se forma junto con pequeñas cantidades de peróxido de litio cuando el metal litio se quema en presencia de aire y se combina con oxígeno, de acuerdo a la siguiente reacción:[2]
4Li + O2 → 2Li2O.
También puede ser producido por la descomposición térmica del peróxido de litio, Li2O2, a 450 °C:[3]
2Li2O2 → 2Li2O + O2
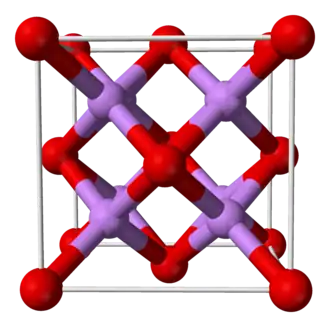
Estructura
Se trata de una sustancia que en estado sólido adopta una estructura de fluoruro similar al CaF2 (fluoruro de calcio).[2]
Usos
El óxido de litio se utiliza como fundente en esmaltes cerámicos. Asimismo, reacciona con el agua y el vapor para formar hidróxido de litio.
Véase también
Referencias
- ↑ Número CAS
- ↑ a b «Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums». Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie. 1934.
- ↑ Greenwood, Norman N. Chemistry of the Elements. Pergamon Press. pp. 97–99. ISBN 0-08-022057-6.
Enlaces externos
- Esta obra contiene una traducción parcial derivada de «Lithium oxide» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.