Óxido de estaño(II)
| Óxido de estaño(II) | ||
|---|---|---|
 | ||
_oxide.jpg) | ||
|
Óxido de estaño(II), forma hidratada de color canela pálido | ||
| General | ||
| Fórmula molecular | SnO | |
| Identificadores | ||
| Número CAS | 21651-19-4[1] | |
| Número RTECS | XQ3700000 | |
| ChemSpider | 80298 | |
| PubChem | 88989 | |
| UNII | JB2MV9I3LS | |
| Propiedades físicas | ||
| Masa molar | 135,897109 g/mol | |
| Estructura cristalina | sistema cristalino tetragonal | |
El óxido de estaño(II), (óxido estañoso) es un compuesto de fórmula SnO. Está compuesto por estaño y oxígeno, donde el estaño tiene el estado de oxidación +2. Se presenta en dos formas, una estable de color negro azulado y otra metaestable de color rojo.
Preparación y reacciones
El SnO negro azulado se puede producir calentando el hidrato de óxido de estaño(II), SnO·xH2O (x<1) precipitado cuando una sal de estaño(II) reacciona con un hidróxido alcalino como el NaOH.[2]
El SnO rojo metaestable puede prepararse calentando suavemente el precipitado producido por la acción del amoníaco acuoso sobre una sal de estaño(II).[2]
El SnO puede prepararse como sustancia pura en el laboratorio, mediante el calentamiento controlado de oxalato de estaño(II) (oxalato estañoso) en ausencia de aire o bajo una atmósfera de CO2. Este método también se aplica a la producción de óxido ferroso y óxido manganoso.[3][4]
SnC2O4·2H2O → SnO + CO2 + CO + 2 H2O
El óxido de estaño(II) arde en el aire con una llama verde tenue para formar SnO2.[2]
2 SnO + O2 → 2 SnO2
Cuando se calienta en una atmósfera inerte, se produce una dismutación inicial que da Sn metálico y Sn3O4, que a su vez reacciona para dar SnO2 y Sn metálico.[2]
4SnO → Sn3O4 + Sn
Sn3O4 → 2SnO2 + Sn
El SnO es anfótero, se disuelve en ácido fuerte para dar sales de estaño(II) y en base fuerte para dar estannitas que contienen Sn(OH)3-.[2] Puede disolverse en soluciones ácidas fuertes para dar los complejos iónicos Sn(OH2)32+ y Sn(OH)(OH2)2+,[2] y en soluciones menos ácidas para dar Sn3(OH)42+.[2]Obsérvese que también se conocen las estannitas anhidras, por ejemplo K2Sn2O3, K2SnO2.[5][6][7] El SnO es un agente reductor y se cree que reduce el cobre(I) a grupos metálicos en la fabricación del llamado "vidrio rubí de cobre".[8]
Estructura
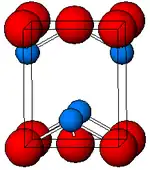
El α-SnO negro adopta la estructura de capa tetragonal PbO que contiene cuatro átomos de estaño piramidales cuadrados coordinados.[9] Esta forma se encuentra en la naturaleza como el raro mineral romarchita.[10] La asimetría se suele atribuir simplemente a un par solitario estéricamente activo; sin embargo, los cálculos de densidad electrónica muestran que la asimetría está causada por una interacción antienlazante de los orbitales Sn(5s) y O(2p).[11] La estructura electrónica y la química del par solitario determinan la mayoría de las propiedades del material.[12]
Se ha observado no estequiometría en el SnO.[13]
La brecha de banda electrónica se ha medido entre 2,5eV y 3eV.[14]
Usos
El óxido de estaño se utiliza principalmente como precursor en la fabricación de otros compuestos o sales de estaño, normalmente divalentes. El óxido estañoso también puede emplearse como agente reductor y en la creación de vidrio rubí.[15]Tiene un uso menor como catalizador de esterificación.
El óxido de cerio(III) en forma cerámica, junto con el óxido de estaño(II) (SnO), se utiliza para la iluminación con luz ultravioleta.[16]
Referencias
- ↑ Número CAS
- ↑ a b c d e f g Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- ↑ Satya Prakash (2000),Advanced Inorganic Chemistry: V. 1, S. Chand, ISBN 81-219-0263-0
- ↑ Arthur Sutcliffe (1930) Practical Chemistry for Advanced Students (1949 Ed.), John Murray - London.
- ↑ Braun, Rolf Michael; Hoppe, Rudolf (1978). «The First Oxostannate(II): K2Sn2O3». Angewandte Chemie International Edition in English 17 (6): 449-450. doi:10.1002/anie.197804491.
- ↑ Braun, R. M.; Hoppe, R. (1982). «Über Oxostannate(II). III. K2Sn2O3, Rb2Sn2O3 und Cs2Sn2O3 - ein Vergleich». Zeitschrift für Anorganische und Allgemeine Chemie 485: 15-22. doi:10.1002/zaac.19824850103.
- ↑ R M Braun R Hoppe Z. Naturforsch. (1982), 37B, 688-694
- ↑ Bring, T.; Jonson, B.; Kloo, L.; Rosdahl, J; Wallenberg, R. (2007), «Colour development in copper ruby alkali silicate glasses. Part I: The impact of tin oxide, time and temperature», Glass Technology, Eur. J. Glass Science & Technology, Part A 48 (2): 101-108, ISSN 1753-3546.
- ↑ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ Ramik, R. A.; Organ, R. M.; Mandarino, J. A. (2003). «On Type Romarchite and Hydroromarchite from Boundary Falls, Ontario, and Notes on Other Occurrences». The Canadian Mineralogist 41 (3): 649-657. doi:10.2113/gscanmin.41.3.649.
- ↑ Walsh, Aron; Watson, Graeme W. (2004). «Electronic structures of rocksalt, litharge, and herzenbergite SnO by density functional theory». Physical Review B 70 (23): 235114. Bibcode:2004PhRvB..70w5114W. doi:10.1103/PhysRevB.70.235114.
- ↑ Mei, Antonio B.; Miao, Ludi; Wahila, Matthew J.; Khalsa, Guru; Wang, Zhe; Barone, Matthew; Schreiber, Nathaniel J.; Noskin, Lindsey E.; Paik, Hanjong; Tiwald, Thomas E.; Zheng, Qiye (21 de octubre de 2019). «Adsorption-controlled growth and properties of epitaxial SnO films». Physical Review Materials 3 (10): 105202. Bibcode:2019PhRvM...3j5202M. S2CID 208008118. doi:10.1103/PhysRevMaterials.3.105202.
- ↑ Moreno, M. S.; Varela, A.; Otero-Díaz, L. C. (1997). «Cation nonstoichiometry in tin-monoxide-phaseSn1−δOwith tweed microstructure». Physical Review B 56 (9): 5186-5192. doi:10.1103/PhysRevB.56.5186.
- ↑ Science and Technology of Chemiresistor Gas Sensors By Dinesh K. Aswal, Shiv K. Gupta (2006), Nova Publishers, ISBN 1-60021-514-9
- ↑ "Red Glass Coloration - A Colorimetric and Structural Study" By Torun Bring. Pub. Vaxjo University.
- ↑ Peplinski, D.R.; Wozniak, W.T.; Moser, J.B. (1980). «Spectral Studies of New Luminophors for Dental Porcelain». Journal of Dental Research (Jdr.iadrjournals.org) 59 (9): 1501-1506. PMID 6931128. S2CID 20191368. doi:10.1177/00220345800590090801. Consultado el 5 de abril de 2012.
Enlaces externos
- Esta obra contiene una traducción derivada de «Tin(II) oxide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.