Ácido tiosulfúrico
| Ácido tiosulfúrico | ||
|---|---|---|
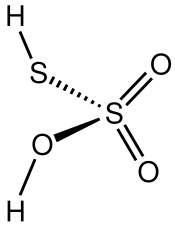 Fórmula estructural | ||
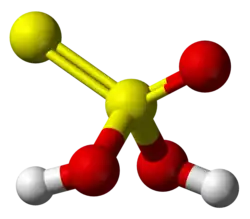 Modelo 3D | ||
| General | ||
| Fórmula estructural | Imagen de la estructura | |
| Fórmula molecular | H2S2O3 | |
| Identificadores | ||
| Número CAS | 13686-28-7[1] | |
| ChEBI | 5587 29279, 5587 | |
| ChEMBL | CHEMBL1208642 | |
| ChemSpider | 22886 | |
| DrugBank | DB09499 | |
| PubChem | 18931838 24478, 18931838 | |
| UNII | 7K79Y2EKKP | |
| KEGG | C05529 | |
| Propiedades físicas | ||
| Masa molar | 113,944536 g/mol | |
El ácido tiosulfúrico es un compuesto inorgánico de fórmula H
2S
2O
3. Ha despertado el interés académico por ser un compuesto sencillo, de fácil acceso y de naturaleza débil. Sin embargo, tiene pocos usos prácticos.
Preparación y degradación
El ácido no puede producirse acidificando soluciones acuosas de sal de tiosulfato, ya que se descompone fácilmente en agua. Los productos de descomposición pueden incluir azufre, dióxido de azufre, sulfuro de hidrógeno, polisulfuros, ácido sulfúrico y politionatos, dependiendo de las condiciones de reacción.[2] Max Schmidt desarrolló métodos anhidros para producir el ácido. [2] [3]
- H
2S + SO
3 → H
2S
2O
3 - Na
2S
2O
3 + 2 HCl → 2 NaCl + H
2S
2O
3 - HSO
3Cl + H
2S → HCl + H
2S
2O
3
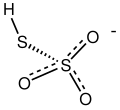
El ácido anhidro también se descompone por encima de -5 °C:
- H
2S
2O
3 → H
2S + SO
3
Estructura
El isómero(O=)
2S(−OH)(−SH) es más estable que el isómero (O=)(S=)S(−OH)
2 según lo establecido por Hartree–Fock. La estructura predicha teóricamente se ajusta a la regla del doble enlace.
Un isómero del ácido tiosulfúrico es el aducto de sulfuro de hidrógeno y trióxido de azufre, H
2S·SO
3, que también se puede preparar a baja temperatura. Es un sólido cristalino blanco.[2]
Referencias
- ↑ Número CAS
- ↑ a b c Greenwood, Norman. N.; Earnshaw, A. (1984). Preface. Elsevier. pp. v-vi. ISBN 978-0-08-030712-1. Consultado el 22 de abril de 2025.
- ↑ Schmidt, Max (1957), «Über Säuren des Schwefels. I. Zur Kenntnis der wasserfreien Thioschwefelsäure», Z. Anorg. Allg. Chem. 289 (1–4): 141-57, doi:10.1002/zaac.19572890113.
- ↑ Miaskiewicz, Karol; Steudel, Ralf (1992), «The Structures of Thiosulfuric Acid H
2S
2O
3 and Its Monoanion HS
2O−
3», Angew. Chem. Int. Ed. Engl. 31 (1): 58-59, doi:10.1002/anie.199200581.
Enlaces externos
- Esta obra contiene una traducción derivada de «Thiosulfuric acid» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.