Ácido hiponitroso
| Ácido hiponitroso | ||
|---|---|---|
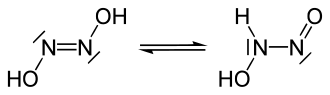 | ||
 | ||
| Nombre IUPAC | ||
| Ácido monoxonítrico (III) | ||
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 14448-38-5[1] | |
| ChEBI | 14428 | |
| ChemSpider | 55636 | |
| PubChem | 135398676, 135476779, 135496072 61744, 135398676, 135476779, 135496072 | |
| KEGG | C01818 | |
| Propiedades físicas | ||
| Masa molar | 62,011627 g/mol | |
El ácido hiponitroso es un compuesto químico con la fórmula HNO. Puede formularse como HON=NOH siendo un isómero de la nitramida, (H2N−NO2). Forma cristales blancos que son explosivos en estado seco.[2] Hay dos posibles estructuras, trans y cis, y el sólido se cree que es la forma trans.[2]
El ácido hiponitroso es un ácido débil (pk1 = 7.21, pK2= 11.54) en disolución acuosa y se descompone a N2O y agua con una vida media de 16 días a 25 °C a un pH ácido de 1-3.[2]
- H2N2O2 → H2O + N2O
Como esta reacción no es reversible, el N2O no debería ser considerado como el anhídrido del H2N2O2.[2]
El ácido hiponitroso forma dos series de sales, los "hiponitritos" que contienen aniones [HON=NO]− y los hiponitritos que contienen el anión [ON=NO]2−.[2]
El ácido puede prepararse a partir de hiponitrito de plata y HCl anhidro en éter:
- Ag2N2O2 + 2HCl → H2N2O2 + 2AgCl
El hiponitrito de plata puede prepararse por la reducción del nitrito de sodio:[3]
- 2NaNO2 + 4Na/Hg + 2H2O + 2AgNO3 → Ag2N2O2 + 2NaNO3 + 4NaOH + 4Hg
Aplicaciones y Propiedades del Ácido Hiponitroso
El ácido hiponitroso es un ácido químico utilizado en diversas aplicaciones industriales debido a sus propiedades únicas. Entre las aplicaciones más comunes se encuentran:
Formación de cristales blancos: El ácido hiponitroso puede formar cristales blancos que son explosivos en estado seco. Estos cristales tienen una estructura específica, siendo generalmente la forma trans la más común.
Producción de hiponitritos: Este ácido forma dos series de sales, conocidas como hiponitritos, que contienen los aniones [HON=NO]− y [ON=NO]2−. Estos hiponitritos son importantes en varias reacciones químicas.
Reacciones químicas en disolución acuosa: El ácido hiponitroso es un ácido débil (pK₁ = 7.21, pK₂= 11.54) y se descompone en N₂O y agua con una vida media de 16 días a 25 °C a un pH ácido de 1-3. Esta reacción no es reversible, por lo que el N₂O no debe considerarse como el anhídrido del H₂N₂O₂.
Preparación a partir de hiponitrito de plata: El ácido hiponitroso se puede preparar mediante la reacción del hiponitrito de plata con HCl anhidro en éter, resultando en la formación de H₂N₂O₂ y AgCl.
El ácido hiponitroso, con su fórmula química H₂N₂O₂, presenta propiedades y aplicaciones industriales específicas que lo hacen un componente esencial en ciertos procesos químicos. Es fundamental manejarlo con cuidado debido a su naturaleza explosiva y sus posibles efectos sobre la salud y el medio ambiente.
Referencias
Enlaces externos
- Esta obra contiene una traducción derivada de «Hyponitrous acid» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.