Ácido hipofosfórico
| Ácido hipofosfórico | ||
|---|---|---|
| Nombre IUPAC | ||
| Ácido hipodifosfórico | ||
| General | ||
| Otros nombres | Ácido difosfórico | |
| Fórmula estructural |
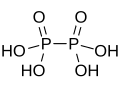 | |
| Fórmula molecular | H4P2O6 | |
| Identificadores | ||
| Número CAS | 7803-60-3[1] | |
| ChEBI | 29263 | |
| ChemSpider | 22943 | |
| PubChem | 24536 | |
| UNII | CY8Z35442Z | |
| Propiedades físicas | ||
| Masa molar | 161,948 g/mol | |
| Punto de fusión | 54 °C (327 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido hipofosfórico es un ácido mineral de fórmula H4P2O6, con el fósforo en estado de oxidación formal +4. En estado sólido se presenta como dihidrato, H4P2O6·2H2O. En el ácido hipofosfórico, los átomos de fósforo son idénticos y están unidos directamente por un enlace P-P. El ácido isohipofosfórico es un isómero estructural del ácido hipofosfórico en el que un fósforo tiene un hidrógeno unido directamente a él y ese átomo de fósforo está unido al otro por un puente de oxígeno, formando un anhídrido mixto ácido fosforoso/ácido fosfórico. Los dos átomos de fósforo se encuentran en los estados de oxidación +3 y +5, respectivamente.
Preparación y reacciones
El ácido hipofosfórico se puede preparar mediante la reacción del fósforo rojo con clorito de sodio a temperatura ambiente. [2]
- 2 P + 2 NaClO2 + 2 H2O → Na2H2P2O6 + 2 HCl
Se produce una mezcla de hipofosfórico, ácido fosforoso (H3PO3) y ácido fosfórico (H3PO4) cuando el fósforo blanco se oxida en el aire al sumergirse parcialmente en agua. [2]
La sal tetrasódica Na4P2O6·10H2O cristaliza a pH 10 y la sal disódica, Na2H2PO6·6H2O a pH 5,2. La sal disódica puede separarse mediante una columna de intercambio iónico para formar el ácido dihidrato, H4P2O6·2H O. [2]
El ácido anhidro puede formarse por deshidratación al vacío sobre P4O10 o por la reacción del H2S sobre hipofosfato de plomo, Pb2P2O6 .
El ácido hipofosfórico es tetraprótico con constantes de disociación pKa1 = 2,2, pKa2 = 2,8, pKa3 = 7,3 y pKa4 = 10,0.
En reposo, el ácido anhidro se reorganiza y desproporciona para formar una mezcla de ácido isohipofosfórico, HPO(OH)-O-PO2(OH); ácido pirofosfórico, H2P2O7, y ácido pirofosfórico.
El ácido hipofosfórico es inestable en ácido clorhídrico caliente,4 M HCl, ya que se hidroliza para dar H3PO3 + H3PO4.
Estructura
El ácido hipofosforoso contiene iones oxonio y su fórmula es [H3O+]2 [H2P2O6]2−. El ácido es isoestructural con la sal diamónica que contiene el anión [HOPO2PO2OH]2− con una longitud de enlace P−P de 219 pm. [2]
El anión HOPO2PO2OH2− en Na2H2P2O6·6H2O tiene una estructura simétrica y escalonada similar al etano con un enlace P−P de longitud 219 p.m. Cada átomo de fósforo tiene dos enlaces P-O de 151 pm de longitud y un enlace P-OH de 159 pm [3]
Sales de hipofosfato
Se conocen muchas sales de hipofosfato, por ejemplo, K4P2O6·8H2O, Ca2P2O6·2H2O, K3HP2O6·3H2O, K2H2P2O6·2H2O, KH3P2O6 .
Al permanecer en el aire, los hipofosfatos tienden a oxidarse a pirofosfatos que contienen el ión P
2O4−
7 donde P tiene un estado de oxidación formal de +5. Los hipofosfatos son estables frente a los hidróxidos alcalinos. En hidróxido de sodio fundido se convierten rápidamente en ortofosfatos que contienen PO3−
4. [2]
Polihipofosfatos
Se conocen polihipofosfatos que contienen aniones lineales, por ejemplo Na5P3O8 que contienen O(PO
2)3O5− con una cadena P−P−P y Na6 P4O10·2H2O que contieneO(PO
2)4O6−, con una cadena P−P−P−P. El anión cíclico (PO
2)6−
6, (hipohexametafosfato) [4] en el que cada átomo de fósforo tiene un estado de oxidación de +3, se forma cuando se oxida una suspensión de fósforo rojo en KOH con bromo. [2]
Referencias
- ↑ Número CAS
- ↑ a b c d e f Phosphorus: Chemistry, Biochemistry and Technology, Sixth Edition, 2013, D.E.C. Corbridge, CRC Pres, Taylor Francis Group, ISBN 978-1-4398-4088-7
- ↑ Collin, R. L.; Willis, M. (1971). «The crystal structure of disodium dihydrogen hypophosphate hexahydrate (Na2H2P2O6·6H2O) and disodium dihydrogen pyrophosphate hexahydrate (Na2H2P2O7·6H2O)». Acta Crystallographica Section B 27 (2): 291-302. ISSN 0567-7408. doi:10.1107/S0567740871002127.
- ↑ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, p. 715. ISBN 0-12-352651-5
Enlaces externos
- Esta obra contiene una traducción derivada de «Hypophosphoric acid» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.