Ácido hipofluoroso
| Ácido hipofluoroso | ||
|---|---|---|
 Estructura en fase gaseosa | ||
 | ||
| General | ||
| Fórmula estructural |
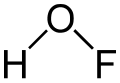 | |
| Fórmula molecular | HOF | |
| Identificadores | ||
| Número CAS | 14034-79-8[1] | |
| ChEBI | 47864 | |
| ChemSpider | 109936 | |
| PubChem | 123334 | |
| Propiedades físicas | ||
| Masa molar | 36,001143 g/mol | |
| Punto de fusión | −117 °C (156 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido hipofluoroso, con la fórmula química HOF, es el único oxiácido de flúor conocido y el único oxoácido en el que el átomo principal gana electrones del oxígeno para alcanzar un estado de oxidación negativo. El estado de oxidación del oxígeno en este ácido (y en el ion hipofluorito OF−
, así como en sus sales llamadas hipofluoritos) es 0, mientras que su valencia es 2. También es el único ácido hipohaloso que puede aislarse como sólido. El HOF es un intermediario en la oxidación del agua por el flúor, que produce fluoruro de hidrógeno, difluoruro de oxígeno, peróxido de hidrógeno, ozono y oxígeno. El HOF es explosivo a temperatura ambiente y forma HF y O2:[2]
- 2 HOF → 2 HF + O
2
Esta reacción es catalizada por el agua. [3]
Se aisló de forma pura haciendo pasar gas F2 sobre hielo a -40 °C, recogiendo rápidamente el gas HOF lejos del hielo y condensándolo. [3]
- F
2 + H
2O → HOF + HF
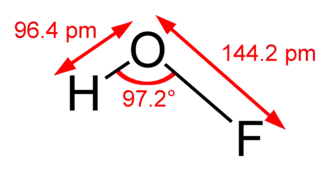
El compuesto se ha caracterizado en fase sólida mediante cristalografía de rayos X como una molécula doblada con un ángulo de 101° y longitudes de enlace O-F y O-H de 144,2 y 96,4 picómetros, respectivamente. La estructura sólida está formada por cadenas con enlaces O-H-O. La estructura también se ha analizado en fase gaseosa, en la que el ángulo de enlace H-O-F es ligeramente más estrecho (97,2°).
Los químicos suelen llamar «reactivo de Rozen» a una solución de ácido hipofluoroso en acetonitrilo (que se genera in situ haciendo pasar flúor gaseoso por agua en acetonitrilo).
Diferencia con otros ácidos hipohalosos
El estado de oxidación formal del oxígeno en el ácido hipofluoroso y el hipofluorito es 0; el mismo estado de oxidación que se encuentra en el oxígeno molecular . En la mayoría de los compuestos de oxígeno, incluidos los demás ácidos hipohalosos, el oxígeno adquiere un estado de -2. El átomo de oxígeno (0) es la raíz de la fuerza del ácido hipofluoroso como oxidante, en contraste con el átomo de halógeno (+1) en otros ácidos hipohalógenos.
Esto altera la química del ácido. Cuando la reducción de un ácido hipohaloso general reduce el átomo de halógeno y produce el gas halógeno elemental correspondiente,
- 2 HOX + 2 H+
+ 2 e−
→ 2 H
2O + X
2
La reducción del ácido hipofluoroso, en cambio, reduce el átomo de oxígeno y produce fluoruro directamente.
- HOF + H+
+ 2 e−
→ H
2O + F−
A diferencia de otros ácidos hipohalosos, el HOF es un oxidante más débil que el flúor elemental.
Hipofluoritos
Los hipofluoritos son formalmente derivados del OF−
, que es la base conjugada del ácido hipofluoroso. Un ejemplo es la hipofluorita trifluorometílica (CF3OF), que es un éster trifluorometílico del ácido hipofluoroso. La base conjugada se conoce en sales como el hipofluorito de litio.
Véase también
- Ácido hipocloroso, un compuesto relacionado que es más importante tecnológicamente pero que no se ha obtenido en forma pura..
Referencias
- ↑ Número CAS
- ↑ W. Poll; G. Pawelke; D. Mootz; E. H. Appelman (1988). «The Crystal Structure of Hypofluorous Acid : Chain Formation by O-H · · · O Hydrogen Bonds». Angew. Chem. Int. Ed. Engl. 27 (3): 392-3. doi:10.1002/anie.198803921.
- ↑ a b Appelman, Evan H. (1 de abril de 1973). «Nonexistent compounds. Two case histories». Accounts of Chemical Research (en inglés) 6 (4): 113-117. ISSN 0001-4842. doi:10.1021/ar50064a001.
Enlaces externos
- Esta obra contiene una traducción derivada de «Hypofluorous acid» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.