Vitamina K epóxido reductasa
La vitamina K epóxido reductasa (VKOR) es una enzima (EC 1.1.4.1) que reduce a la vitamina K luego de que esta ha sido oxidada en la carboxilación del residuo de ácido glutámico de las enzimas que participan en la coagulación de la sangre.
| VKOR | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 1.1.4.1 | |||
| Ortólogos | ||||
| Especies |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Vitamina K epóxido reductasa | ||||
|---|---|---|---|---|
| Identificadores | ||||
| Símbolos | VKORC1 (HGNC: 23663) VKCFD2 | |||
| Identificadores externos | ||||
| Locus | Cr. 16 p11.2 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| RefSeq (ARNm) |
| |||
La reacción catalizada por esta enzima es:
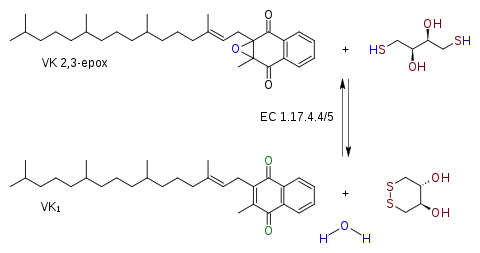
La VKORC es miembro de una amplia familia de enzimas que se encuentran presentes en vertebrados, Drosohpila, plantas, bacterias, y arqueas.[1] La subunidad 1 de esta enzima (VKORC1) es la diana del anticoagulante warfarina.[2][3] En la región más probable para ser el sitio activo de la enzima se han identificado cuatro residuos de cisteína y un quinto residuo que puede ser serina o treonina.[1] En algunas enzimas homólogas de plantas y bacterias, el dominio homólogo a la VKORC1 se encuentra fusionado con otros dominios de la familia de la tioredoxina de oxidoreductasas.[1]
Referencias
- Goodstadt L, Ponting CP (June 2004). «Vitamin K epoxide reductase: homology, active site and catalytic mechanism». Trends Biochem. Sci. 29 (6): 289-92. PMID 15276181. doi:10.1016/j.tibs.2004.04.004.
- Li, T; Chang, CY; Jin, DY; Lin, PJ; Khvorova, A; Stafford, DW (2004). «Identification of the gene for vitamin K epoxide reductase». Nature 427 (6974): 541-4. PMID 14765195. doi:10.1038/nature02254.
- Rost, S; Fregin, A; Ivaskevicius, V; Conzelmann, E; Hortnagel, K; Pelz, HJ; Lappegard, K; Seifried, E et al. (2004). «VKORC1 cause warfarin resistance and multiple coagulation factor deficiency type 2». Nature 427 (6974): 537-41. PMID 14765194. doi:10.1038/nature02214.