Reducción de Fukuyama
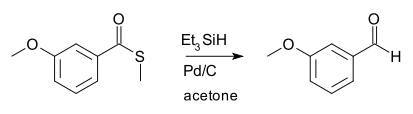
La reducción de Fukuyama es una reacción orgánica y una reducción orgánica en la que un tioéster es reducido a un aldehído por un hidruro de sililo en presencia de una cantidad catalítica de paladio. Esta reacción fue descubierta en 1990 por Tohru Fukuyama.[1] En un primer alcance, el hidruro de sililo era el hidruro de trietilsililo, y el catalizador era paladio en carbono:
 La reducción de Fukuyama
La reducción de Fukuyama
Las reducciones de Fukuyama son usadas para la conversión de ácidos carboxílicos (como precursores tioésteres) a aldehídos, lo que es considerado un procedimiento difícil, debido a la facilidad de una segunda reducción a un alcohol.
Mecanismo de reacción
El mecanismo de reacción básico para esta reacción toma lugar como un ciclo catalítico:
- R-C(O)-SR + pd(0) → RC(O)-Pd(II)-SR
- RC(O)-Pd(II)-SR + R3SiH → RC(O)-Pd(II)-H + R3Si-SR
- RC(O)-Pd(II)-H → RC(O)-H + Pd(0)
Aplicaciones
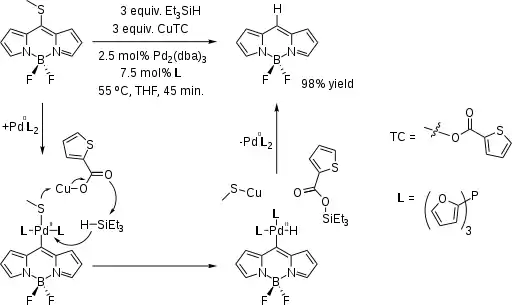
En una variación de la reducción de Fukuyama, el núcleo de la molécula BODIPY fue sintetizado a partir del derivado sustituido Sme:[2][3]
En el Acoplamiento de Fukuyama, relacionada con esta reacción, el hidruro es reemplazado por un nucleófilo de carbono
Referencias
- Facile reduction of ethyl thiol esters to aldehydes: application to a total synthesis of (+)-neothramycin A methyl ether Tohru Fukuyama, Shao Cheng Lin, Leping Li J. Am. Chem. Soc., 1990, 112 (19), pp 7050–7051 doi 10.1021/ja00175a043
- The Smallest and One of the Brightest. Efficient Preparation and Optical Description of the Parent Borondipyrromethene System. I. J. Arroyo, R. Hu, G. Merino, B. Z. Tang, E. Peña-Cabrera, J. Org. Chem. 2009, ASAP
- Reactivos adicionales: CuTC, Pd(dba)2, tri(2-furil)fosfina