Formamida
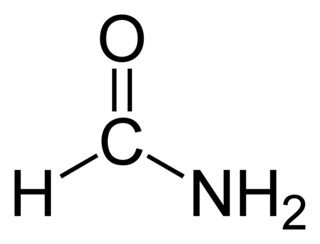
La formamida (también conocida como metanamida) es la amida derivada del ácido fórmico. Su fórmula molecular es CH3NO. Se trata de un líquido de color claro, totalmente miscible con agua y de olor amoniacal. Es la amida primaria más simple.
| Formamida | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| metanamida | ||
| General | ||
| Fórmula molecular | CH3NO | |
| Identificadores | ||
| Número CAS | 75-12-7[1] | |
| ChEBI | 16397 | |
| ChEMBL | CHEMBL266160 | |
| ChemSpider | 693 | |
| PubChem | 713 | |
| UNII | 4781T907ZS | |
| KEGG | C00488 | |
| Propiedades físicas | ||
| Densidad | 1133 kg/m³; 1,133 g/cm³ | |
| Masa molar | 45,04 g/mol | |
| Propiedades químicas | ||
| Acidez | 23.5 (en DMSO) pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis
En el pasado, la formamida se producía tratando al ácido fórmico con amoníaco, que produce formiato de amonio, que a su vez produce formamida al calentarse:[2]
- HCOOH + NH3 → HCOO−NH+
4 - HCOO−NH+
4 → HCONH2 + H2O
La formamida también se genera por amonólisis del formato de etilo:[3]
- HCOOCH2CH3 + NH3 → HCONH2 + CH3CH2OH
Un proceso industrial más moderno implica la carbonilación del amoniaco:[4]
- CO + NH3 → HCONH2
Un proceso alternativo de dos etapas implica la amonolisis de formiato de metilo, que se forma a partir de monóxido de carbono y metanol:
- CO + CH3OH → HCOOCH3
- HCO2CH3 + NH3 → HCONH2 + CH3OH
Reactividad
La formamida se hidroliza en agua con catálisis ácida y calor:
- HCONH2 + H2O → HCOOH + NH3
La formamida se descompone en monóxido de carbono y amoniaco a 180 °C.
- HCONH2 → CO + NH3
En presencia de catalizadores ácidos sólidos, la formamida se deshidrata a ácido cianhídrico:[5]
- HC(O)NH2 → HCN + H2O
Referencias
- Número CAS
- Lorin, M. (1864). «Preparation of Formamide by means of Formiates and Oxalates». The Chemical News and Journal of Physical Science IX: 291. Consultado el 14 de junio de 2014.
- Phelps, I. K.; Deming, C. D. (1908). «The Preparation of Formamide from Ethyl Formate and Ammonium Hydroxide». The Chemical News and Journal of Physical Science 97: 86-87. Consultado el 14 de junio de 2014.
- Hohn, A. (1999). "Formamide". In Kroschwitz, Jacqueline I. (ed.). Kirk-Othmer Concise Encylclopedia of Chemical Technology (4th ed.). New York: John Wiley & Sons, Inc. pp. 943–944. ISBN 978-0471419617.
- Plantilla:Ullmann