CA14
El Gen CA14 o Anhidrasa carbónica 14, en el humano codifica la isoforma 14 de la familia alfa de la enzima anhidrasa carbónica.[2]
| CA14 | ||||
|---|---|---|---|---|
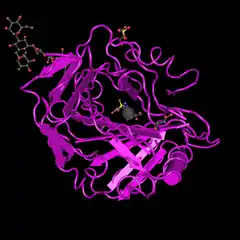 Estructura cristalina de la anhidrasa carbónica 14 humana, utilizando difracción de rayos X. Resolución 2 Å. Estructura en complejo con un inhibidor 1.1'bifenil-4-sulfonamida | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 4.2.1.1 | |||
| Locus | Cr. 1 1q21.2 | |||
| Estructura/Función proteica | ||||
| Tamaño | 337 aa (aminoácidos) | |||
| Peso molecular | 37.6 kDa (Da) | |||
| Estructura | Globular | |||
| Tipo de proteína | Enzima | |||
| Funciones | Metabolismo | |||
| Dominio proteico | Anhidrasa carbónica alfa aa: 20-278 | |||
| Datos enzimáticos | ||||
| Cofactor(es) | Zn2+ | |||
| KM | 7.9 mM | |||
| Información adicional | ||||
| Localización subcelular | Membrana plasmática | |||
| Modificaciones | Glucosidacíon en asparagina 213, enlaces disulfuro entre 40,221 y fosfoserina 325 | |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Nucleótidos |
mRNA lineal de 1834 pb[1] |
| Sinónimos |
CAXIV, carbonato deshidratasa XIV, anhidrasa carbónica XIV, deshidratasa carbónica |
| Ortólogos |
Ratón (Mus musculus): Car14 Zorro (Vulpes vulpes): Ca14 Conejo (Oryctolagus cuniculus: CA14 Toro (Bos indicus): CA14 Perro (Canis lupus familiaris): CA14 Mono macaco (Macaca mulatta): CA14 Chimpanće (Pan troglodytes): CA14 Caballo (Equus caballus): CA14 Lobo (Canis lupus dingo): *CA14 Cabra (Capra hircus): CA14 Gorila: (Gorilla gorilla) CA14 Gato (Felis catus): CA14 Elefante (Loxodonta africana): CA14 Orangután (Pongo abelii): CA14 Orca (Orcinus orca): CA14 |
| Árbol filogenético | 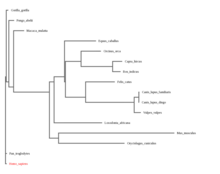 Aquí se utilizó el gen CA XIV comparando los ortólogos antes mencionados y el humano. Se puso como raíz al humano para poder ver mejor la relación filogenética de este con los ortólogos anteriormente mencionados. Se realizó con ayuda del programa DNASubway, línea azul. |
Anhidrasa carbónica
Las anhidrasas carbónicas son una gran familia de metaloenzimas que catalizan la reacción de hidratación reversible de dióxido de carbono (CO2). Además, participan en una variedad de procesos biológicos, que incluyen la respiración, la calcificación, el balance ácido-base, la resorción ósea, así como la formación del humor acuoso, del fluido cerebroespinal, la saliva y el ácido gástrico.
Estas enzimas muestran una gran diversidad en su distribución en los tejidos y en su ubicación subcelular. En específico, se ha predicho que CA14 es una proteína de membrana tipo I y que comparte la más alta similitud en su secuencia con CA12 (una isoforma de CA que también es una proteína transmembranal). Sin embargo, tienen diferentes patrones de expresión en tejidos específicos y por ello pueden llevar a cabo diferentes roles fisiológicos.[3]
La CA 14 humana fue la última descubierta de las quince isoformas de CA. Fue la primera descrita en 1999 por Fujikawa et al. como una putativa proteína de membrana 1.[4]
Función
Gracias a diferentes experimentos, la mayoría en ratones, se hicieron varios descubrimientos que sirvieron para inferir la función del gen. Por ejemplo, en una investigación se mostró una baja pero significativa actividad de CA en células de mamíferos que expresaban el CA14 recombinado. Esta actividad era sensible ante el inhibidor acetazolamida pero no para la sulfanilamida.[5] En otra, al usar la hibridación in situ se encontró que la CA14 de los riñones de los ratones está en el túbulo contorneado proximal, sitio donde ocurre la mayor absorción de bicarbonato, y en el borde externo de la banda interna de la médula espinal. También se encontró que las células expresaban CA14 en la membrana plasmática con su dominio expuesto al espacio extracelular.[6] Utilizando la citoquímica del immunogold detectaron CA14 en células gliales de la retina de ratones y en otras células pero resaltando que estaba en las membranas de cada tipo celular.[7]
Proteína
En general, la función más estudiada de la proteína CA14 es catalizar la reacción reversible de la hidratación del dióxido de carbono (CO2) formando el ion bicarbonato (H2CO3) y protones (H+).[8] Lo hace mediante un proceso de dos pasos:
Presenta una actividad de liasa, y cataliza reacciones de eliminación no hidrolítica, no oxidante, o la lisis de algún sustrato. Estas reacciones generan dobles enlaces a través de eliminación de moléculas de H2O, CO2 y (NH3)+.[9]
- Un hidróxido unido a la molécula de cinc reacciona con el CO2, lo cual genera una molécula de (HCO3)–, que se une al cinc, y, por hidrólisis, el bicarbonato es desplazado mediante un intercambio de enlaces.[9]
- El H+ se transfiere al amortiguador externo mediante un transportador para generar la especie catalítica activa, lo cual permite al cinc volver a unir al hidroxilo.[9]
Localización
Subcelular y celular: Membrana plasmática. Es una proteína transmembranal de paso único tipo 1.[9]
Tisular: Cerebro, colon, intestino delgado, médula espinal, vejiga, riñones, hígado.[10]
Expresión
De acuerdo con un estudio en el que secuenciaron los ARN de diferentes muestras de tejidos de 95 personas, se representaron 27 tejidos diferentes con el fin de obtener la especificidad de los tejidos de los genes codificadores para proteínas (la proteína CA14), los datos que se obtuvieron fueron los siguientes:[11]
- Cerebro
- Próstata
- Piel
- Hígado
- Esófago
- Corazón
- Ovario
- Tiroides
- Estómago
- Intestino delgado
- Duodeno
- Vesícula biliar
- Médula ósea
- Riñón
- Pulmón
Los resultados de los otros tejidos eran muy bajos. En realidad, solamente los primeros cinco resultados mostraron las mejores puntuaciones de expresión.
Entre los estudios, también hubo análisis de un Northern blot que mostró transcritos de aproximadamente 1.7 kb de CA14 en cerebro, hígado, corazón y músculo óseo de humanos adultos. También un dot blot de ARN de un panel grande de tejidos normales humanos adultos y fetales detectó una alta expresión del gen CA14 en todas las partes del sistema nervioso central y una más baja expresión en tejidos de adultos. De los tejidos fetales sometidos a la prueba, únicamente el corazón mostró que expresaba el CA14.[12]
Relevancia clínica
Diferentes niveles en las actividades anormales de esta enzima pueden estar relacionados con diversas enfermedades, como cáncer (colon-rectal, de mama, de próstata, de pulmón y de hígado),[13] epilepsia, glaucomas y melanomas. Por este motivo estas enzimas se han convertido en interesantes blancos para la inhibición para fármacos en el tratamiento de epilepsias, algunas retinopatías y algunos tumores cutáneos, retinitis pigmentosa y aplopejias, o como activador en algunas aplicaciones biomédicas.[10][4]
Actividad enzimática de la proteína CA14
La actividad enzimática de la anhidrasa carbónica está regulada por:
Activadores: histamina, L-adrenalina, L- y D-histidina, y D-fenilalanina.
Inhibidores: cumarina, sacarina, derivados de sulfonamida como la acetazolamida (AZA) y foscarnet (fosfonomorfato trisódico).[14]
- Cataliza la reacción:
- Cinética enzimática:
- para
- Sitios de la enzima:
| Tipo de sitio | Posición |
|---|---|
| Sitio activo - Aceptor de protones | 84 |
| Sitio activo | 144 |
| Unión a metales (cinc) | 109, 111, 135 |
Propiedades cinéticas
Vías que puede tomar el gen
- Hidratación reversible del dióxido de carbono. La familia de las anhidrasas carbónicas desprotona el agua y produce un grupo hidroxilo del cinc y un protón, que mediante residuos de histidina y glutamato se transfiere a moléculas buffer externas. El grupo hidroxilo reacciona con el dióxido de carbono en el sitio activo y genera bicarbonato. Una molécula de agua desplaza al bicarbonato, y se reinicia el ciclo. Actualmente, en humanos se conocen 12 anhidrasas carbónicas.[15]
- Metabolismo del nitrógeno. El proceso biológico del ciclo del nitrógeno es una interacción compleja entre varios organismos que catalizan diferentes reacciones, en la cual el nitrógeno está en varios estados de oxidación, desde +5 en nitrato hasta -3 en amoniaco. El núcleo del ciclo del nitrógeno involucra cuatro vías de reducción y dos vías de oxidación. Quienes desarrollan estas reacciones generalmente son procariontes, gracias a varios complejos enzimáticos, pero en la vía del metabolismo del nitrógeno se encuentran proteínas de la familia CA, como la CA14.[16]
- Metabolismo. Los procesos metabólicos en las células humanas generan energía mediante la oxidación de moléculas que obtienen por su dieta, así como por la síntesis de otras varias moléculas esenciales no existentes en la dieta. También inactivan o eliminan toxinas que se producen endógenamente o que están en el ambiente extracelular. Estos procesos se pueden dividir en dos, si es que ocupan derivados de carbohidratos o derivados de lípidos. Dentro de cada grupo es importante identificar si es que generan energía o hacen síntesis con ellos.[17]
Interacciones
CA14 ha sido capaz de interaccionar con:[18]
- AP1M1
- ATR
- CIP2A
- COG2, COG4, COG7, COG8
- DCPS
- DNM1L
- EIF2B1, EIF2B2, EIF2B3, EIF2B4, EIF2B5
- ERMP1
- EVA1B
- EXOC1, EXOC5, EXOC6, EXOC6B, EXOC7, EXOC8
- FANCD2
- HEATR1
- IQCB1
- KIF14
- KNTC1
- LTN1
- MON2
- MTOR
- NCAPH2
- NF1
- NUP160, NUP85
- PEX19
- PI4KA
- PLAA
- RANBP6
- RRP1
- SAAL1
- SLC22A18, SLC38A7
- THADA
- TNPO2
- XPO4, XPO6
- ZNF273
Referencias
- https://www.ncbi.nlm.nih.gov/nuccore/NM_012113.2
- Fujikawa-Adachi K, Nishimori I, Taguchi T, Onishi S (Nov 1999). "Human carbonic anhydrase XIV (CA14): cDNA cloning, mRNA expression, and mapping to chromosome 1". Genomics. 61 (1): 74–81. doi:10.1006/geno.1999.5938. PMID 10512682
- «CA14 carbonic anhydrase 14 [Homo sapiens (human)] - Gene - NCBI». www.ncbi.nlm.nih.gov (en inglés). Consultado el 18 de septiembre de 2018.
- Alterio, Vincenzo; Pan, Peiwen; Parkkila, Seppo; Buonanno, Martina; Supuran, Claudiu T.; Monti, Simona M.; De Simone, Giuseppina (19 de abril de 2014). «The structural comparison between membrane-associated human carbonic anhydrases provides insights into drug design of selective inhibitors». Biopolymers (en inglés) 101 (7): 769-778. ISSN 0006-3525. doi:10.1002/bip.22456. Consultado el 20 de septiembre de 2018.
- Fujikawa-Adachi, K.; Nishimori, I.; Taguchi, T.; Onishi, S. (1 de octubre de 1999). «Human carbonic anhydrase XIV (CA14): cDNA cloning, mRNA expression, and mapping to chromosome 1». Genomics 61 (1): 74-81. ISSN 0888-7543. PMID 10512682. doi:10.1006/geno.1999.5938. Consultado el 18 de septiembre de 2018.
- Mori, K.; Ogawa, Y.; Ebihara, K.; Tamura, N.; Tashiro, K.; Kuwahara, T.; Mukoyama, M.; Sugawara, A. et al. (28 de mayo de 1999). «Isolation and characterization of CA XIV, a novel membrane-bound carbonic anhydrase from mouse kidney». The Journal of Biological Chemistry 274 (22): 15701-15705. ISSN 0021-9258. PMID 10336468. Consultado el 18 de septiembre de 2018.
- Nagelhus, Erlend A.; Mathiisen, Thomas M.; Bateman, Allen C.; Haug, Finn-M.; Ottersen, Ole P.; Grubb, Jeffrey H.; Waheed, Abdul; Sly, William S. (31 de mayo de 2005). «Carbonic anhydrase XIV is enriched in specific membrane domains of retinal pigment epithelium, Muller cells, and astrocytes». Proceedings of the National Academy of Sciences of the United States of America 102 (22): 8030-8035. ISSN 0027-8424. PMC 1142392. PMID 15901897. doi:10.1073/pnas.0503021102. Consultado el 18 de septiembre de 2018.
- «Human Carbonic Anhydrase XIV (CA14): cDNA Cloning, mRNA Expression, and Mapping to Chromosome 1». Genomics (en inglés) 61 (1): 74-81. 1 de octubre de 1999. ISSN 0888-7543. doi:10.1006/geno.1999.5938. Consultado el 18 de septiembre de 2018.
- Monroy, Lorena Espinosa; Vargas, Martha Patricia Sierra (2010). «Anhidrasa carb�nica, nuevas perspectivas». NCT Neumolog�a y Cirug�a de T�rax (en español) 69 (4). ISSN 0028-3746. Consultado el 20 de septiembre de 2018.
- Alterio, Vincenzo; Pan, Peiwen; Parkkila, Seppo; Buonanno, Martina; Supuran, Claudiu T.; Monti, Simona M.; De Simone, Giuseppina (2014-7). «The structural comparison between membrane-associated human carbonic anhydrases provides insights into drug design of selective inhibitors». Biopolymers 101 (7): 769-778. ISSN 1097-0282. PMID 24374484. doi:10.1002/bip.22456. Consultado el 19 de septiembre de 2018.
- «CA14 carbonic anhydrase 14 [Homo sapiens (human)] - Gene - NCBI». www.ncbi.nlm.nih.gov (en inglés). Consultado el 19 de septiembre de 2018.
- «OMIM Entry - * 604832 - CARBONIC ANHYDRASE XIV; CA14». www.omim.org (en inglés estadounidense). Consultado el 20 de septiembre de 2018.
- «Expression of CA14 in cancer - Summary - The Human Protein Atlas». www.proteinatlas.org. Consultado el 20 de septiembre de 2018.
- «CA14 - Carbonic anhydrase 14 precursor - Homo sapiens (Human) - CA14 gene & protein». www.uniprot.org (en inglés). Consultado el 18 de septiembre de 2018.
- «Reactome | Reversible hydration of carbon dioxide». www.reactome.org (en inglés británico). Consultado el 18 de septiembre de 2018.
- structure. «Nitrogen metabolism - BioSystems - NCBI». www.ncbi.nlm.nih.gov. Consultado el 19 de septiembre de 2018.
- structure. «Metabolism - BioSystems - NCBI». www.ncbi.nlm.nih.gov. Consultado el 19 de septiembre de 2018.
- «CA14 carbonic anhydrase 14 [Homo sapiens (human)] - Gene - NCBI». www.ncbi.nlm.nih.gov (en inglés). Consultado el 18 de septiembre de 2018.
- Esta obra contiene una traducción parcial derivada de «CA14» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.