1,2-dicloro-2-metilpropano
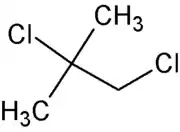
El 1,2-dicloro-2-metilpropano, llamado también 1,2-dicloroisobutano o cloruro de 2-cloroisobutirilo, es un compuesto orgánico de fórmula molecular C4H8Cl2. Es un haloalcano ramificado de cuatro carbonos con dos átomos de cloro, isómero de los distintos diclorobutanos.[2][3][4]
| 1,2-dicloro-2-metilpropano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1,2-dicloro-2-metilpropano | ||
| General | ||
| Otros nombres |
1,2-dicloroisobutano Cloruro de 2-cloroisobutililo | |
| Fórmula semidesarrollada | CH3-CCl(CH3)-CH2Cl | |
| Fórmula molecular | C4H8Cl2 | |
| Identificadores | ||
| Número CAS | 594-37-6[1] | |
| Número RTECS | TX5030000 | |
| ChemSpider | 105392 | |
| PubChem | 117943 | |
|
CC(C)(CCl)Cl
| ||
| Propiedades físicas | ||
| Apariencia | Líquido | |
| Densidad | 1095 kg/m³; 1,095 g/cm³ | |
| Masa molar | 12 701 g/mol | |
| Punto de fusión | −70 °C (203 K) | |
| Punto de ebullición | 105 °C (378 K) | |
| Presión de vapor | 32,9 mmHg | |
| Índice de refracción (nD) | 1,437 | |
| Propiedades químicas | ||
| Solubilidad en agua | 465 mg/L | |
| log P | 2,43 | |
| Familia | Haloalcano | |
| Peligrosidad | ||
| Punto de inflamabilidad | 289 K (16 °C) | |
| NFPA 704 |
3
3
0
| |
| Compuestos relacionados | ||
| cloroalcanos |
1-cloro-2-metilpropano 2-cloro-2-metilpropano | |
| policloroalcanos |
1,2,3,4-tetraclorobutano 1,1,1,3,3-pentaclorobutano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
A temperatura ambiente, el 1,2-dicloro-2-metilpropano es un líquido que tiene su punto de ebullición a 105 °C y su punto de fusión a -70 °C. Posee una densidad mayor que la del agua (ρ = 1,095 g/cm³). El valor del logaritmo de su coeficiente de reparto, logP = 2,43, revela que es más soluble en disolventes apolares que en disolventes polares. Es poco soluble en agua (465 mg/L aproximadamente)[3] e incompatible con agentes oxidantes fuertes así como con bases fuertes.[5]
Síntesis
El isobutileno reacciona con cloro dando lugar a 1,2-dicloro-2-metilpropano como producto mayoritario cuando la reacción es activada por luz en ausencia de oxígeno.[6] La síntesis de 1,2-dicloro-2-metilpropano también puede realizarse a partir de 3-cloro-2-metil-1-propeno usando una mezcla de trimetilclorosilano y agua con un rendimiento del 67%.[7] Otra vía de síntesis es por cloración de alcohol 1-cloro-terc-butílico empleando fósforo (V) como catalizador. Con este último método el rendimiento alcanza el 87%.[8]
Usos
El 1,2-dicloro-2-metilpropano se emplea como oxidante en tetrahidrofurano (THF) en diversas reacciones: síntesis de naftalenos polisustituidos,[9] síntesis de fenantrenos vía benzanulación [4+2],[10] arilación de propionamidas 2,2-sustituidas,[11] arilación de alquenos con reactivos de Grignard[12] y arilación/alquenilación de enlaces C(sp3)-H.[13] De forma general, todas estas reacciones están catalizadas por hierro.
En este sentido, la reacción entre una amida de zinc primaria y un reactivo de diorganozinc da lugar a una amina secundaria en presencia de tris(acetilacetonato) de hierro (III) (Fe(acac)3) como catalizador y 1,2-dicloro-2-metilpropano como oxidante. El 1,2-dicloro-2-metilpropano es esencial para lograr la formación de enlaces C-N, presumiblemente por la formación de una especie catalítica intermedia de hierro con grupos arilo y amido.[14]
Precauciones
El 1,2-dicloro-2-metilpropano es un compuesto muy inflamable, tanto en forma líquida como en vapor, que tiene su punto de inflamabilidad a 16 °C. Puede formar mezclas explosivas con el aire y su descomposición térmica genera cloruro de hidrógeno. El contacto con esta sustancia produce irritación en piel y ojos, severa en este último caso. Se sospecha que puede provocar defectos genéticos y cáncer.[5]
Véase también
Los siguientes compuestos son isómeros del 1,2-dicloro-2-metilpropano:
Referencias
- Número CAS
- 1,2-Dichloro-2-methylpropane (PubChem)
- 1,2-Dichloro-2-methylpropane (ChemSpider)
- 1,2-Dichloroisobutane (Chemical Book)
- «1,2-Dichloro-2-methylpropane. MSDS (synquest)». Archivado desde el original el 11 de enero de 2020. Consultado el 11 de enero de 2020.
- Taft, Jr., R.W. (1948). «Substitution vs. Addition in the Low Temperature Non-activated Chlorination of Olefins, an Argument for an Ionic Substitution Mechanism». J. Am. Chem. Soc. 70 (10): 3364-3369. Consultado el 12 de enero de 2020.
- Boudjouk, P.; Kim, B.-K.; Han, B.H. (1996). «Trimethylchlorosilane and Water. Convenient Reagents for the Regioselective Hydrochlorination of Olefins». Synthetic Communications 26 (18): 3479-3484. Consultado el 12 de enero de 2020.
- Denton, R.M.; An, J.; Adeniran, B.; Blake, A.J.; Lewis, W.; Poulton, A.M. (2011). «Catalytic Phosphorus(V)-Mediated Nucleophilic Substitution Reactions: Development of a Catalytic Appel Reaction». J. Org. Chem. 76 (16): 6749-6767. Consultado el 12 de enero de 2020.
- Ilies, L.; Matsumoto, A.; Kobayashi, M.; Yoshikai, N.; Nakamura, E. (2012). «Synthesis of Polysubstituted Naphthalenes by Iron-Catalyzed [2+2+2] Annulation of Grignard Reagents with Alkynes». Synlett 23 (16): 2381-2384. Consultado el 12 de enero de 2020.
- Knochel, P.; Steib, A.K. (2011). «Fe-Catalyzed Phenanthrene Synthesis via [4+2] Benzannulation». Synfacts 7: 774. Consultado el 12 de enero de 2020.
- Knochel, P.; Steib, A.K. (2013). «Iron-Catalyzed Arylation of 2,2-Disubstituted Propionamides». Synfacts 9 (7): 771. Consultado el 12 de enero de 2020.
- Trejos, A.; Odell, L.R. (2013). «3.1.1.5.2.1.2 With Organozinc and Grignard Reagents». Science of Synthesis: Cross Coupling and Heck-Type Reactions 3: 365. Consultado el 12 de enero de 2020.
- Knochel, P.; Ketels, M. (2017). «Directed Arylation and Alkenylation of C(sp3)–H Bonds». Synfacts 13 (2): 188. Consultado el 12 de enero de 2020.
- Nakamura, Y.; Ilies, L.; Nakamura, E. (2011). «Iron-Catalyzed Oxidative Monoarylation of Primary Amines with Organozinc Reagents». Org. Lett. 13 (22): 5998-6001. Consultado el 12 de enero de 2020.
